Quema perfecta: ¿1 mol de O2 es suficiente para quemar 1...?
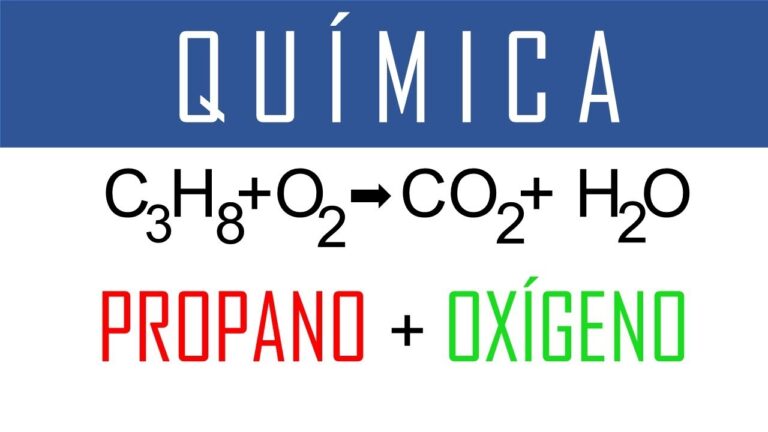
mol de un hidrocarburo?
Muchos procesos químicos requieren de una reacción de combustión para producir energía, por ejemplo, la combustión de hidrocarburos que utilizamos como combustible en los motores de combustión interna o en las plantas de generación de energía eléctrica. Sin embargo, para lograr esta reacción es necesario conocer la cantidad mínima de oxígeno gaseoso que se necesita para quemar una mol de hidrocarburo. En este artículo especializado, se explicará con detalle cuántas moles de oxígeno son necesarias para llevar a cabo esta reacción, así como los factores que intervienen en ella.
¿Qué cantidad de oxígeno gaseoso se requiere para la combustión?
La cantidad de oxígeno gaseoso que se requiere para la combustión depende del tipo de combustible y de las condiciones en las que se lleva a cabo el proceso. En el caso del carbono, por ejemplo, se necesita 2 moles de oxígeno por cada mol de carbono para lograr una combustión completa y generar dióxido de carbono. Esto equivale a una masa de aproximadamente 32 gramos de oxígeno gaseoso por cada 12 gramos de carbono. Es importante tener en cuenta estas proporciones para asegurar una combustión completa y eficiente en procesos industriales y de otro tipo.
Las cantidades de oxígeno necesarias para la combustión varían según el combustible utilizado. Para lograr una combustión completa del carbono y generar dióxido de carbono, se necesitan 2 moles de oxígeno por cada mol de carbono, lo que equivale a aproximadamente 32 gramos de oxígeno gaseoso por cada 12 gramos de carbono. Es importante conocer estas proporciones para asegurar una combustión eficiente en procesos industriales y otros.
¿Cuántos moles de oxígeno se requieren para la combustión de un mol de gas metano?
En la combustión del gas metano, se requieren 2 moles de oxígeno por cada mol de metano. Esta relación estequiométrica permite conocer la cantidad de reactivo necesario para dicha reacción. Además, al considerar la estequiometría, es posible calcular las cantidades de productos obtenidos a partir de la cantidad inicial de reactantes. Es importante tener en cuenta estas relaciones para realizar una combustión adecuada y eficiente de metano y lograr una disminución en la emisión de gases contaminantes.
La relación estequiométrica entre el gas metano y el oxígeno es crucial para lograr una combustión eficiente y reducir la emisión de gases contaminantes. Esta proporción de 2 moles de oxígeno por cada mol de metano permite calcular las cantidades de reactantes necesarios y de productos obtenidos. Es fundamental tener en cuenta estas relaciones para llevar a cabo una combustión adecuada del metano.
¿Cuál es la cantidad de oxígeno que corresponde a un mol?
Un mol de oxígeno es la cantidad de oxígeno que contiene exactamente 6,02 · 1023 moléculas de O2. Esta cantidad se conoce como la constante de Avogadro y se utiliza como una unidad de medida estándar en la química. Es importante destacar que la cantidad de oxígeno en un mol depende del tipo de oxígeno y de su estado físico, ya sea gaseoso, líquido o sólido. Esta unidad de medida es fundamental en la química para realizar cálculos precisos relacionados con la cantidad de sustancias y su reactividad.
La constante de Avogadro es una unidad de medida estándar en la química, utilizada para calcular la cantidad de sustancias. Un mol de oxígeno contiene exactamente 6,02 · 1023 moléculas de O2, y su uso es fundamental en la realización de cálculos precisos en la química. La cantidad de oxígeno en un mol depende del tipo y estado físico del mismo.
Determinación del número de moles de oxígeno requeridos para la combustión completa de una molécula de gas
Uno de los principales cálculos en la química de la combustión es determinar el número de moles de oxígeno necesario para la combustión completa de una molécula de gas. Este cálculo es fundamental para entender la termodinámica de la reacción y para poder realizar una combustión eficiente. La determinación del número de moles de oxígeno se realiza a través del conocimiento de las propiedades de la molécula de gas y la reacción química que se llevará a cabo. Con esta información se puede calcular la cantidad de oxígeno requerida para la combustión completa del gas y asegurarse de que la reacción sea completa y eficiente.
En la química de la combustión es crucial determinar el número de moles de oxígeno necesarios para una combustión completa de una molécula de gas. Este cálculo se realiza teniendo en cuenta las propiedades del gas y la reacción química a llevar a cabo, garantizando así una combustión eficiente y completa.
La química detrás de la combustión: cálculo de la cantidad de oxígeno necesaria para la reacción
La reacción de combustión es un proceso químico en el que un combustible reacciona con oxígeno para producir dióxido de carbono, agua y energía en forma de calor. Para que la reacción se lleve a cabo, se necesita una cantidad precisa de oxígeno. El cálculo de la cantidad necesaria de oxígeno depende del tipo de combustible utilizado, su masa y la ecuación de combustión. Para garantizar una combustión eficiente, es crucial asegurarse de que la cantidad de oxígeno disponible sea adecuada para una reacción completa.
La combustión es un proceso químico que produce dióxido de carbono, agua y energía en forma de calor. La cantidad necesaria de oxígeno depende del combustible utilizado y su masa; es importante tener en cuenta esto para garantizar una combustión eficiente.
¿Cuántas moléculas de oxígeno son necesarias para una combustión completa? Un enfoque molecular en la química de la combustión
La química de la combustión se basa en la reacción química entre un combustible y un oxidante, generalmente oxígeno. En una combustión completa, todas las moléculas de combustible se oxidan por completo produciendo dióxido de carbono y agua. La cantidad de moléculas de oxígeno necesarias para una combustión completa depende de la cantidad de átomos de carbono e hidrógeno presentes en el combustible. Por ejemplo, para la combustión completa del metano, se requieren dos moléculas de oxígeno. Es importante comprender la cantidad de oxígeno necesaria para lograr una combustión completa para evitar la formación de contaminantes como el monóxido de carbono.
En la química de la combustión, la reacción química entre un combustible y un oxidante es esencial para permitir la producción completa de dióxido de carbono y agua. La cantidad de oxígeno requerida para lograr una combustión total varía según la cantidad de átomos de carbono e hidrógeno en el combustible, lo que es crucial para evitar la aparición de contaminantes como el monóxido de carbono en la combustión.
¿Cuántas moles de oxígeno necesitamos para obtener una reacción de combustión eficiente? Una inmersión profunda en las ecuaciones de reacciones químicas.
La cantidad de moles de oxígeno necesaria para generar una reacción de combustión eficiente depende del compuesto que se esté utilizando como combustible. Para determinar la cantidad necesaria, es necesario conocer la ecuación química de la reacción y balancearla. De esta forma, se podrá conocer el coeficiente estequiométrico del oxígeno y determinar la cantidad de moles necesaria. Por lo tanto, no existe una respuesta única a esta pregunta, ya que dependerá de la composición química y propiedades del combustible utilizado.
En la industria de la combustión, se requiere conocer la cantidad de moles de oxígeno necesaria para una reacción eficiente y esto depende del compuesto combustible. Para determinar esta cantidad, se debe balancear la ecuación química de la reacción y hallar el coeficiente estequiométrico del oxígeno, lo que permitirá conocer la cantidad de moles necesaria de este gas. Es importante tener en cuenta que, debido a la variabilidad de los combustibles, la respuesta a esta pregunta no es universal.
Mol de metano?
la reacción de combustión del metano con oxígeno gaseoso es altamente exotérmica y es una de las reacciones más comunes que ocurren en la combustión de combustibles fósiles. A partir de la ecuación estequiométrica de esta reacción, se puede deducir que para quemar una mol de metano, se necesitan dos moles de oxígeno gaseoso. Es importante destacar que esta ecuación solo es aplicable en condiciones estándar de presión y temperatura, por lo que es necesario tener en cuenta las variables externas que pueden afectar la combustión de los combustibles en el mundo real. En cualquier caso, el conocimiento de la cantidad de oxígeno necesario para la combustión del metano es fundamental para entender este proceso y sus implicaciones en el medio ambiente y la salud humana.